"Khi bước chân vào thế giới hóa học, chúng ta không thể bỏ qua sự kỳ diệu của bài học số 9 - sự biến đổi tuần hoàn tính chất của các nguyên tố hóa học và định luật tuần hoàn. Nhưng sau những hàng và cột trên bảng tuần hoàn, chúng ta sẽ khám phá một thế giới phức tạp và đa dạng, nơi tính chất và sự biến đổi không ngừng trong những nguyên tố. Hãy cùng Hoidapnhanh tìm hiểu về vấn để này nha.
A. LÝ THUYẾT
I. TÍNH KIM LOẠI, TÍNH PHI KIM
- Tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương được gọi là tính kim loại. Tính kim loại của nguyên tử phụ thuộc vào mức độ dễ mất electron của nó.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó có khả năng thu hút electron và tạo ra một ion âm. Tính phi kim của nguyên tử phụ thuộc vào khả năng thu hút electron của nó.
- Trong Bảng tuần hoàn các nguyên tố hoá học (trang 37) có những đường dích dắc in đậm phân cách ranh giới tương đối giữa các nguyên tố kim loại và phi kim. Các nguyên tố phi kim ở phía phải và các nguyên tố kim loại ở phía trái.
1. Sự biến đổi tính chất trong một chu kì
- Trong một chu kì, theo chiều tăng dẫn của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, đồng thời tính phi kim mạnh dần.
Thí dụ : Chu kì 3 bắt đầu từ nguyên tố Na (Z = 11), [Ne]3s1, là một kim loại điển hình. Rồi lần lượt đến Mg (Z = 12), [Ne]3s2, là kim loại mạnh nhưng hoạt động kém natri. Al (Z = 13), [Ne]3s23p1, là một kim loại nhưng hiđroxit đã có tính chất lưỡng tính. Si (Z = 14), [Ne]3s23p2 là một phi kim. Từ P (Z = 15), [Ne]3s23p3 đến S (Z = 16), [Ne]3s23p4 tính phi kim mạnh dần. Cl (Z = 17), [Ne]3s23p5, là một phi kim điển hình, rồi đến khí hiếm Ar (Z = 18), [Ne]3s23p6. Quy luật trên được lặp lại đối với mỗi chu kì.
Theo bán kính nguyên tử, quy luật biến đổi tính chất trên có thể được giải thích như sau:
- Khả năng dễ nhường electron (đặc trưng cho tính kim loại của nguyên tố) giảm dần đồng thời khả năng thu electron (đặc trưng cho tính phi kim của nguyên tố) tăng dần. Điều này xảy ra trong khi số lớp electron của các nguyên tử bằng nhau và điện tích của hạt nhân tăng dần
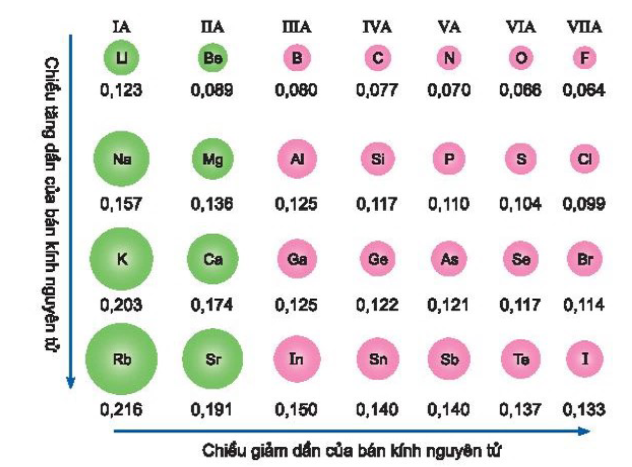
Hình 2.1. Bảng kinh nguyên tử của một số nguyên tố (nm) Trong mỗi chu kì, bản kính nguyên tử giảm từ trái qua phải. Trong mỗi nhóm A, bản kinh nguyên tử tăng theo chiều từ trên xuống dưới.
2. Sự biến đổi tính chất trong một nhóm A
- Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần.
Thí dụ :
- Nhóm IA gồm các kim loại điển hình : Tính chất kim loại tăng rõ rệt từ Li (Z = 3), 1s22s1 đến Cs (Z = 55), [Xe]6s1 tức là khả năng mất electron tăng dần. Xesi là nguyên tố kim loại mạnh nhất.
- Nhóm VIIA gồm các phi kim điển hình : Tính phi kim giảm dần từ F (Z = 9), 1s22s22p5 đến I (Z = 53), [Kr] 4d105s25p5, tức là khả năng thu thêm electron giảm dần. Flo là nguyên tố phi kim mạnh nhất.
- Các nhóm A khác lặp lại quy luật đó. Nó được giải thích như sau: Trong một nhóm A, điện tích hạt nhân tăng theo chiều từ trên xuống dưới cùng với số lớp electron. Điều này dẫn đến việc bán kính nguyên tử của các nguyên tố tăng nhanh và chiếm ưu thế hơn. Do đó, tính kim loại tăng lên khi khả năng nhường electron của các nguyên tố
- Kim loại mạnh nhất là Cs, có bán kính nguyên tử lớn nhất. Nguyên tử F là phi kim mạnh nhất vì nó có bán kính nguyên tử nhỏ nhất.
3. Độ âm điện
a) Khái niệm
- Khả năng của một nguyên tử hút electron khi hình thành liên kết hoá học được thể hiện bằng độ âm điện của nguyên tử đó.
- Do đó, tính phi kim của nguyên tử tăng lên theo độ âm điện của nó. Ngược lại, tính kim loại của nguyên tử tăng lên theo độ âm điện của nó.
b) Bảng độ âm điện
- Các tác giả đã tính toán nhiều thang độ âm điện khác nhau trong hoá học trên các cơ sở khác nhau. Nhà hoá học Pau-linh (Pauling) đã thiết lập bảng giá trị độ âm điện vào năm 1932. Pau-linh quy ước lấy độ âm điện của flo, nguyên tố phi kim mạnh nhất, để xác định độ âm điện tương đối của các nguyên tử khác.
Bảng 6. Giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A theo Pau-linh
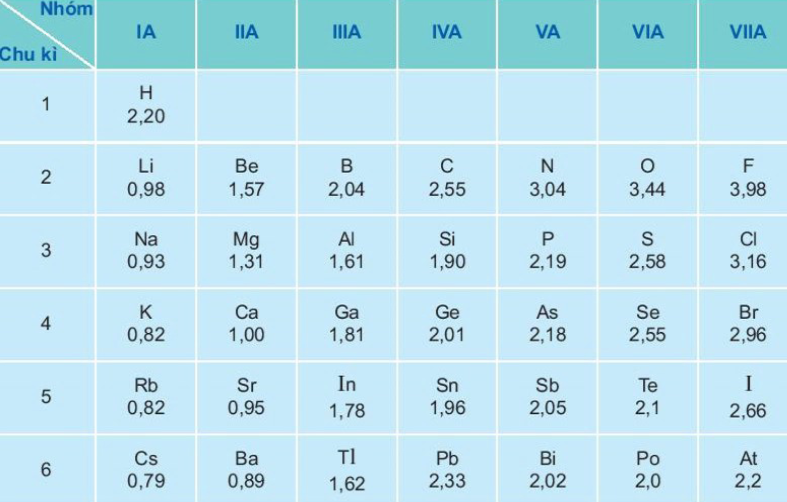
- Giá trị độ âm điện của các nguyên tử thường tăng theo chiều tăng của điện tích hạt nhân trong một chu kỳ.
- Giá trị độ âm điện của các nguyên tử trong một nhóm A giảm dần theo chiều tăng của điện tích hạt nhân.
- Sự thay đổi tính kim loại và tính phi kim của các nguyên tố trong một chu kì và trong nhóm A đã được xem xét ở trên được phù hợp với quy luật biến đổi độ âm điện.
- Kết luận: Tính kim loại và tính phi kim của các nguyên tố thay đổi khi điện tích hạt nhân tăng.
II. HOÁ TRỊ CỦA CÁC NGUYÊN TỐ
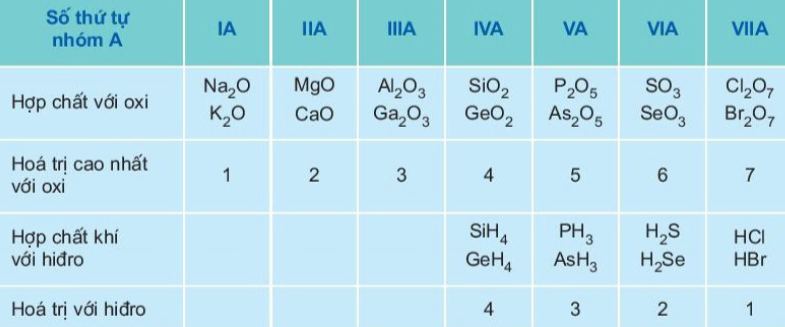
- Trong một chu kì, đi từ trái sang phải, hoá trị cao nhất của các nguyên tố trong hợp chất với oxi tăng lần lượt từ 1 đến 7, còn hoá trị của các phi kim trong hợp chất với hiđro giảm từ 4 đến 1.
- Thí dụ, trong chu kì 3, ba nguyên tố đầu chu kì (Na, Mg, Al) tạo thành hợp chất oxit, trong đó chúng có hoá trị lần lượt là 1, 2, 3. Các nguyên tố tiếp theo (Si, P, S, Cl) có hoá trị lần lượt là 4, 5, 6, 7 trong oxit cao nhất.
- Các nguyên tố phi kim Si, P, S, C1 tạo được hợp chất khí với hiđro, trong đó chúng có hoá trị lần lượt 4, 3, 2, 1. Đối với các chu kì khác, sự biến đổi hoá trị của các nguyên tố cũng diễn ra tương tự (xem bảng 7).
Bảng 7. Sự biến đổi tuần hoàn hoá trị của các nguyên tố
III. OXIT VÀ HIĐROXIT CỦA CÁC NGUYÊN TỐ NHÓM A THUỘC CÙNG CHU KÌ
- Tính bazơ của các oxit và hiđroxit tương ứng yếu dần và tính axit của chúng mạnh dần trong suốt một chu kỳ, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân.
Bảng 8. Sự biến đổi tính axit – bazơ
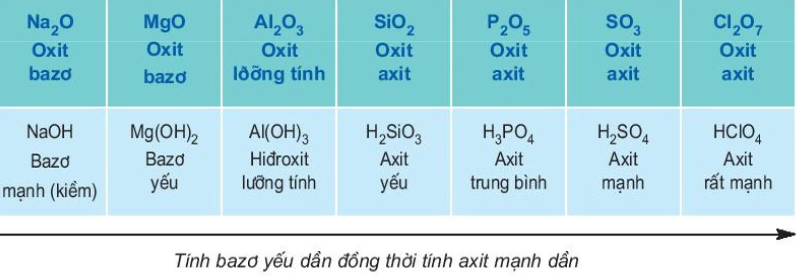
Sự biến đổi tính chất như thế được lặp lại ở các chu kì sau.
IV. ĐỊNH LUẬT TUẦN HOÀN
- Khảo sát sự biến đổi tuần hoàn của cấu hình electron, bán kính, độ âm điện và tính kim loại và phi kim của các nguyên tố hoá học, cũng như thành phần và tính chất của các hợp chất của chúng, chúng ta thấy tính chất của các nguyên tố hoá học biến đổi theo chiều điện
Định luật tuần hoàn về các nguyên tố hoá học được phát biểu như sau :
- Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Mời bạn xem thêm: BÀI 8: SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HÓA HỌC CÓ GIẢI BÀI TẬP
Mời bạn xem thêm: BÀI 7: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC CÓ GIẢI BÀI TẬP
Mời bạn xem thêm: BÀI 6: LUYỆN TẬP : CẤU TẠO VỎ NGUYÊN TỬ CÓ GIẢI BÀI TẬP
Mời bạn xem thêm: BÀI 5: CẤU HÌNH ELECTRON NGUYÊN TỬ CÓ GIẢI BÀI TẬP
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI:
Câu 1.(Trang 47 SGK)
Trong một chu kì, bán kính nguyên tử các nguyên tố
A. tăng theo chiều tăng dần của điện tích hạt nhân.
B. giảm theo chiều tăng dần của điện tích hạt nhân.
C. giảm theo chiều tăng của tính phi kim
D. B và C đều đúng.
Chọn đáp án đúng nhất.
Bài giải:
Đáp án D
Trong một chu kì, bán kính nguyên tử các nguyên tố giảm theo chiều tăng dần của điện tích hạt nhân và giảm theo chiều tăng của tính phi kim
Câu 2.(Trang 47 SGK)
Trong một nhóm A, bán kính nguyên tử của các nguyên tố:
A. tăng theo chiều tăng của điện tích hạt nhân.
B. giảm theo chiều tăng của điện tích hạt nhân.
C. giảm theo chiều giảm của tính kim loại.
D. A và C đều đúng.
Chọn đáp án đúng nhất.
Bài giải:
Đáp án D
Trong một nhóm A, bán kính nguyên tử của các nguyên tố giảm theo chiều tăng của điện tích hạt nhân đồng nghĩa với giảm theo chiều giảm của tính kim loại.
Câu 3.(Trang 47 SGK)
Những tính chất nào sau đây biến đổi tuần hoàn ?
a) Hóa trị cao nhất với oxi.
b) Nguyên tử khối.
c) Số electron lớp ngoài cùng.
d) Số lớp electron.
e) Số electron trong nguyên tử.
Bài giải:
Những tính chất sau đây biến đổi tuần hoàn là hóa trị cao nhất với oxi và số electron lớp ngoài cùng.
Trong một chu kì, đi từ trái sang phải, hóa trị cao nhất với oxi tăng lần lượt từ I → VII, còn hóa trị với hiđro của các phi kim giảm từ IV đến I.
Câu 4.(Trang 47 SGK)
Các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần (từ trái sang phải) như sau:
A. I, Br, Cl, F.