"Bảng tuần hoàn các nguyên tố hóa học - một biểu đồ đầy mê hoặc và bí ẩn, đã từ lâu thu hút sự tò mò của những người yêu khoa học. Bên cạnh việc thể hiện sự phân bố và sắp xếp thông tin về các nguyên tố, bảng tuần hoàn còn chứa đựng những câu đố về cấu trúc và tính chất của vũ trụ. Đây không chỉ là một bảng liệt kê khô khan, mà là một khung cảnh tuyệt đẹp về sự phức tạp và sự liên kết của các thành phần cơ bản của sự tồn tại. Để hiểu rõ hơn về mặt tinh tế và giá trị thực sự của bảng tuần hoàn, Hãy cùng Hoidapnhanh khám phá và thực hiện những bài tập giải quyết những câu đố khó nhằn mà nó đặt ra."

A. LÝ THUYẾT
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
-
Ngày nay, dựa trên thuyết cấu tạo nguyên tử, các nguyên tố hoá học được sắp xếp theo các nguyên tắc và được gọi là các bảng tuần hoàn:
1. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
3. Các nguyên tố có số electron hoá trị (1) trong nguyên tử như nhau được xếp thành một cột.
Bảng các nguyên tố được sắp xếp theo các nguyên tắc trên được gọi là bảng tuần hoàn các nguyên tố hoá học (gọi tắt là bảng tuần hoàn).
II. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
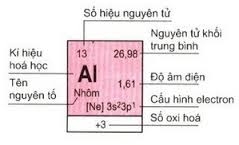
1. Ô nguyên tố
-
Mỗi nguyên tố hoá học được đặt trong một ô trên bảng. Những ô này được gọi là "ô nguyên tố".
Số hiệu của một nguyên tố bằng số thứ tự của nó.
Thí dụ : Nhôm (Al) có ô 13 trong bảng tuần hoàn, có số hiệu nguyên tử là 13, điện tích đơn vị của hạt nhân là 13 và vỏ nguyên tử của Al có 13 electron.
2. Chu kì
-
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
-
Chu kì thường bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1 và chu kì 7 chưa hoàn thành).
-
Bảng tuần hoàn gồm 7 chu kì. Các chu kì được đánh số từ 1 đến 7. Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Chu kì 1 gồm 2 nguyên tố là H (Z = 1), 1s1 và He (Z = 2), 1s2.
-
Nguyên tử của hai nguyên tố này chỉ có 1 lớp electron, đó là lớp K.
Chu kì 2 gồm 8 nguyên tố, bắt đầu là Li (Z = 3), 1s22s1 và kết thúc là
Ne (Z = 10), 1s22s22p6.
-
Nguyên tử của các nguyên tố này có 2 lớp electron : lớp K (gồm 2 electron) và lớp L. Số electron của lớp L tăng dần từ 1 ở liti đến tối đa là 8 ở neon (lớp electron ngoài cùng bão hoà).
Chu kì 3 gồm 8 nguyên tố, bắt đầu từ Na (Z = 11), 1s22s22p63s1 . và kết thúc là
-
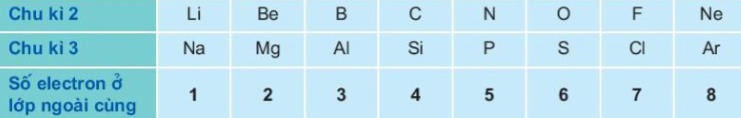
Ar (Z = 18), 1s22s22p63s23p6. Nguyên tử của các nguyên tố này có 3 lớp elec- tron : lớp K (2 electron), lớp L (8 electron) và lớp M. Số electron của lớp M tăng dần từ 1 ở natri đến tối đa là 8 ở agon (lớp electron ngoài cùng bền vững). Bảng dưới đây cho biết số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 2 và 3.
Chu kì 4 và chu kì 5 : Mỗi chu kì đều có 18 nguyên tố, bắt đầu là một kim loại kiềm (K (Z = 19) : [Ar]4s1 và Rb (Z = 37) : [Kr]5s1), kết thúc là một khí hiếm (Kr (Z = 36) : [Ar]3d104s24p6 và Xe (Z = 54) : [Kr]4d105s25p6).
Chu kì 6 : Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs (Z = 55), [Xe]6s1 và kết thúc là khí hiếm Rn (Z = 86), [Xe]4f145d106s26p6.
Chu kì 7: Chưa hoàn thành.
Các chu kì 1, 2, 3 được gọi là các chu kì nhỏ.
Các chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
-
14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6 (được gọi là các nguyên tố thuộc họ Lantan) và 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7 (gọi là các nguyên tố thuộc họ Actini) có cấu hình electron đặc biệt, được xếp thành hai hàng ở phần cuối bảng. Như vậy, nếu trừ 14 nguyên tố trên, chu kì 6 cũng còn 18 nguyên tố như các chu kì 4 và 5, chu kì 7 còn 10 nguyên tố,
3. Nhóm nguyên tố
-
Nhóm nguyên tố là một tập hợp các nguyên tố được xếp thành một cột và có cấu hình electron tương tự nhau.
-
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn (xem bảng tuần hoàn, trang 37). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
-
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hoá trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Ngoài cách chia các nguyên tố thành nhóm người ta còn chia chúng thành các khối như sau :
• Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA (được gọi là nhóm kim loại kiềm) và nhóm IIA (được gọi là nhóm kim loại kiềm thổ). Thí dụ :
Na (Z = 11): 1s22s22p63s1;
Mg (Z= 12): 1s22s22p63s2;
Các nguyên tố s hoạt động hoá học rất mạnh, còn được gọi là các kim loại hoạt động. Chúng có khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn hầu hết các kim loại khác.
• Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ He).
Thí dụ :
O (Z= 8): 1s22s22p4;
Ne (Z= 10): 1s22s22p6;
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B.
Khối nguyên tố f gồm các nguyên tố xếp ở hai hàng cuối bảng.
Nhóm B bao gồm các nguyên tố d và nguyên tố f.
Bạn đã xem chưa: 10 Phương pháp học giỏi Hóa lớp 12 một cách có hệ thống
B. BÀI TẬP VÀ HƯỚNG DẪN GIẢI:
Câu 1.(Trang 35 SGK)
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là:
A. 3
B. 5
C. 6
D. 7
Chọn đáp án đúng
Bài giải:
Đáp án C
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron =>chu kì 6 có 6 lớp electron
Câu 2.(Trang 35 SGK)
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là:
A. 3 và 3.
B. 3 và 4
C. 4 và 4
D. 4 và 3
Bài giải: