Nắm chắc được các công thức hóa học cơ bản là yếu tố quan trọng nhất giúp thí sinh làm bài tập dễ dàng. Trong đó, kiến thức hóa học lớp 12 chiếm phần lớn các câu hỏi trong đề thi THPT Quốc gia. Chương trình hóa học lớp 12 tương đối dễ nắm bắt nhưng sẽ rất khó nếu như các em bị hụt bài hoặc không theo kịp. Nhằm củng cố kiến thức cho các em theo cách đơn giản nhất, Hoidapnhanh đã tổng hợp lại tất cả các công thức hóa học 12 chi tiết nhất trong bài viết dưới đây. Đối với môn học có lượng kiến thức lớn, sẽ dễ hơn rất nhiều nếu các em hiểu và nắm rõ phần lý thuyết cơ bản trước khi “nuốt trọn” các công thức liên quan.
Để giúp các em học tập hiệu quả hơn, bài viết đã tổng hợp các công thức hóa học quan trọng cần nhớ dưới đây.
Các công thức hóa học cơ bản lớp 12

Nắm chắc các công thức hóa học cơ bản, học sinh sẽ dễ dàng đạt được điểm cao
Trong môn hóa học lớp 12, học sinh cần chú tâm và các kiến thức liên quan đến kì thi THPT Quốc gia. Các kiến thức trọng tâm bao gồm: Đại cương kim loại, kiềm kiềm thổ- Nhôm, Este-lipit, amin, amino axit, protein, Cacbonhidrat và polime…
Chương trình hóa học lớp 12 tương đối dễ nắm bắt nhưng sẽ rất khó nếu như các em bị hụt bài hoặc không theo kịp. Nhằm củng cố kiến thức cho các em theo cách đơn giản nhất, Hoidapnhanh đã tổng hợp lại tất cả các công thức hóa học 12 chi tiết nhất trong bài viết dưới đây. Đối với môn học có lượng kiến thức lớn, sẽ dễ hơn rất nhiều nếu các em hiểu và nắm rõ phần lý thuyết cơ bản trước khi “nuốt trọn” các công thức liên quan. Hãy cùng Bamboo tìm hiểu để tải ngay file PDF tổng hợp các công thức cực dễ ôn tập nhé!
Chương 1: Este – Lipit
-
Công thức tổng quát của este no, đơn chức, hở:
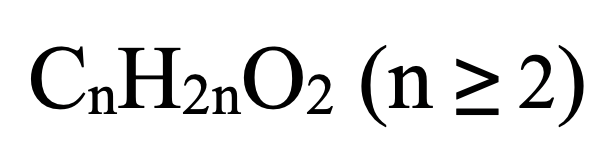
- Tính số đồng phân este đơn chức no:
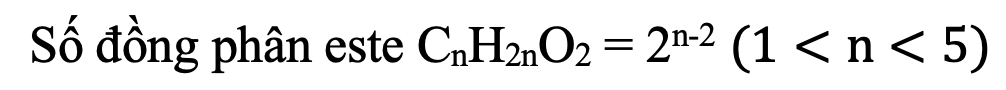
- Tính số triglixerit tạo bởi glixerol với các axit cacboxylic béo:
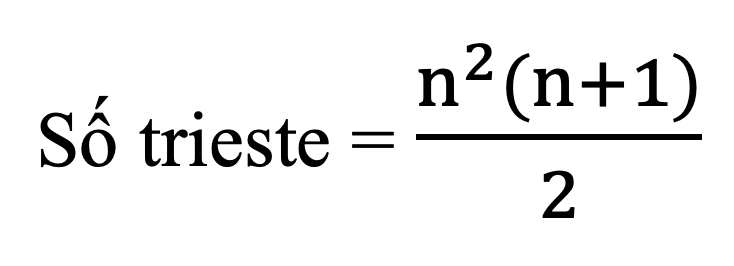
Chương 2: Cacbohiđrat
1. Công thức chung của cacbohiđrat:
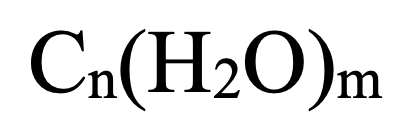
2. Công thức cụ thể của một số cacbohiđrat:
- Tinh bột (hoặc Xenlulozơ):
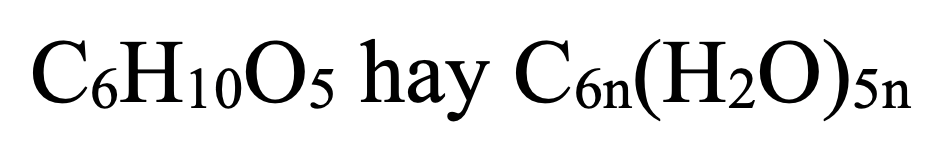
- Glucozơ (hoặc Fructozơ):
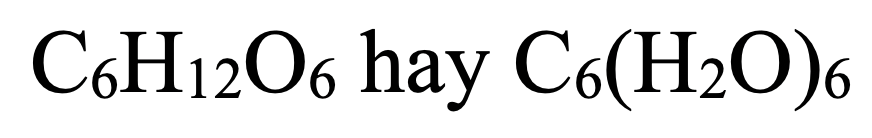
- Saccarozơ (hoặc Mantozơ):
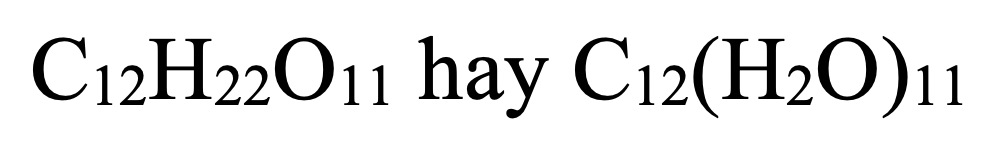
Chương 3: Amin, Amino axit và Protein
-
Công thức tổng quát amin no, đơn chức, hở:
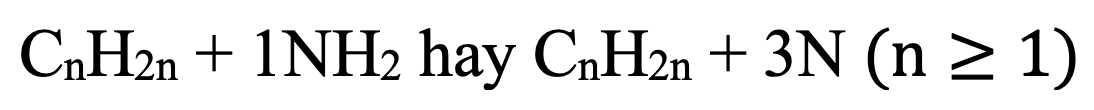
- Tính số đồng phân amin đơn chức no:
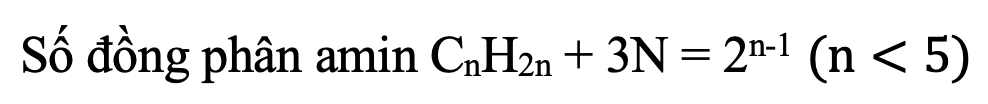
- Tính số đi, tri, tetra…, n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
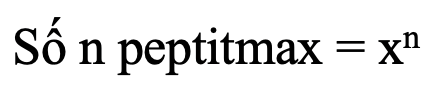
- Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol HCl, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol NaOH:
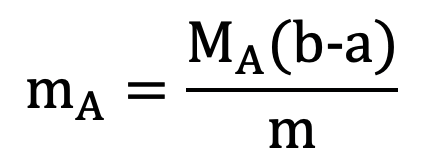
- Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol NaOH, sau đó cho dung dịch sau phản ứng tác dụng vứa đủ với b mol HCl:
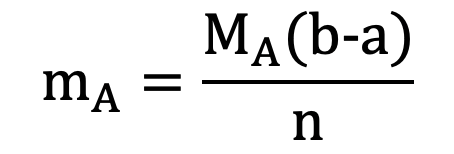
Chương 4: Polime và vật liệu polime
Công thức tính hệ số trùng hợp polime
Giả sử polime có dạng (-A-)n
Ta có:
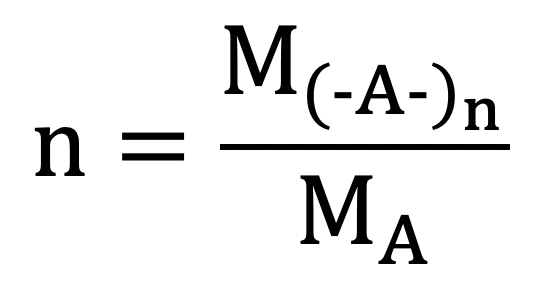
Chương 5: Đại cương về kim loại
1. Dãy hoạt động hóa học của kim loại
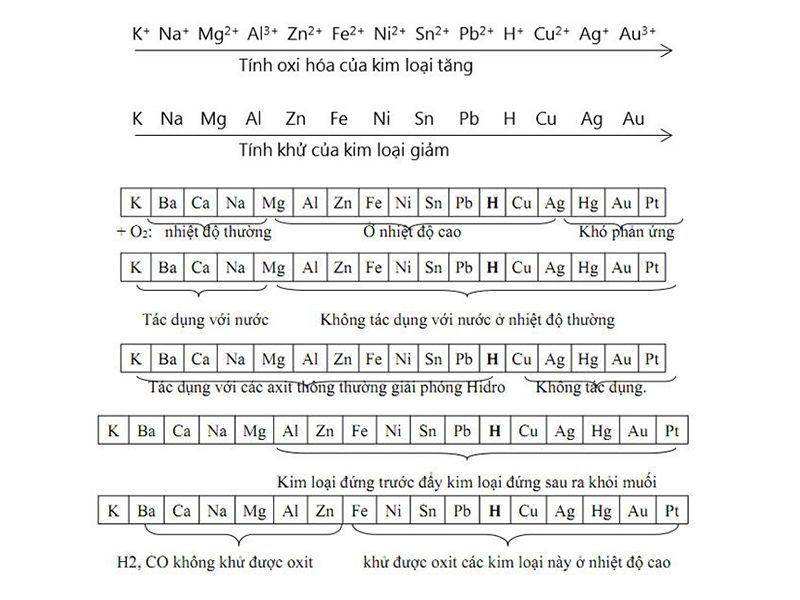
Dãy hoạt động hóa học của kim loại và ý nghĩa
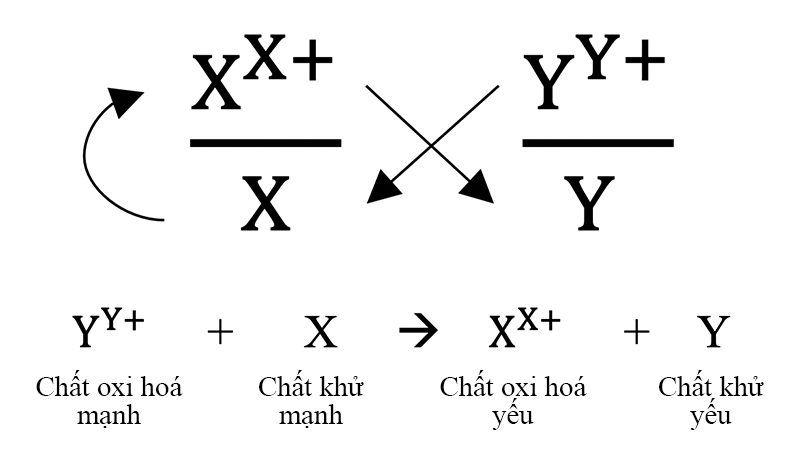
2. Quy tắc anpha
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa).
- Áp dụng quy tắc alpha
Phản ứng xảy ra theo chiều mũi tên như sau:
3. Công thức biểu diễn định luật Faraday
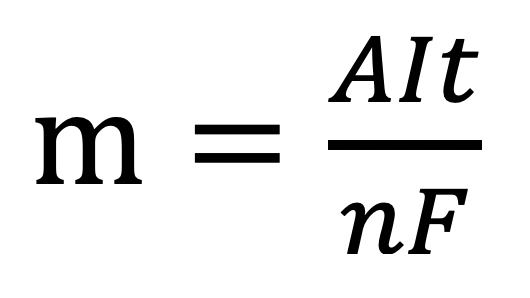
Trong đó:
- m: Khối lượng chất thu được ở điện cực, tính bằng gam.
- A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
- n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
- I: Cường độ dòng điện, tính bằng ampe (A).
- t: Thời gian điện phân, tính bằng giây (s).
- F: Hằng số Faraday (F = 96 500 Culong/mol)
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
1. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:

2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
- Trước hết tính:

- Sau đó so sánh với nBa2+ hoặc nCa2+ để xem chất nào phản ứng hết
3. Tính thể tích CO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
Trường hợp 1: nCO2 = n↓
Trường hợp 2: nCO2 = nOH- – n↓
4. Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nOH- = 3n↓
Trường hợp 2: nOH- = 4nAl3+ – n↓
Kết quả trên tương ứng với hai trường hợp NaOH dùng thiếu và NaOH dùng dư.
- Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
- Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
5. Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nH+ = n↓
Trường hợp 2: nH+ = 4nNa[Al(OH)]4- – 3n↓
Chương 7: Sắt và một số kim loại quan trọng
1. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:

2. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl giải phóng H2:

3. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:

4. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl:

5. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ:

